-
- EMC测试 RoHS测试 EN71测试 质检报告 医疗整改 UN38.3报告 MSDS报告 WERCS认证 PAHS检测 IP防尘防水 CPSIA测试 MEPS认证 EMF测试 RF测试 双酚A检测 IEC62133 LFGB认证 SCCP测试 EMC整改 TSCA认证 JFSL370 REACH测试 CP65认证 ASTM认证
-
检测检验

1、医疗器械注册计划编制
1.1 、医疗器械注册计划编制:药监部门根据申请,依法定程序对拟上市器械安全性、有效性系统评价,决定是否同意上市过程。
1.2、 遵循《医疗器械注册管理办法》及其配套法规、办事指南要求。
1.3、《医疗器械监督管理条例》(650号令)规定
1.4、 产品设计定型后启动注册工作。
1.5、 产品设计定型后启动注册工作。
2、
注册计划编制后提交(
注册人、备案人
以自己名义把产品推向市场,对产品负法律责任
)
2.1 、国产一类:市局备案
2.2 、国产二类:省局注册
2.3 、国产三类:国家局注册
2.4 、进口一类:国家局备案
2.5、 进口二三类:国家局注册
注册费+检验费+临床试验费+咨询费(厂房、样品、人员设备投入另计)
4.1、厂房、设备配备产品设计定型、厂房验收、生产检验设备到位。
4.2、分类查询、试产明确产品分类、注册单元、典型性型号、试产样品。
4.3、注册检测筛选检测机构、准备送检资料、送检跟检、领取检验报告。
4.4、临床评价:
4.4.1、免临床产品搜集信息写评价资料。
4.4.2、开展临床试验。
5、注册申报申报资料编写、受理、体系核查、补正、取证。
5.1、产品分类查询
5.1.1、提交分类界定申请,根据《医疗器械分类规则》进行预分类,申请分类界定。
5.1.2、查询CFDA数据库,参考同类产品分类信息。
5.1.3、查询分类界定文件,确定是否有适用分类界定文件。
5.1.4、查询分类目录,第一类医疗器械产品目录、新修订医疗器械分类目录(征求意见稿)。
5.2、申请分类界定
5.2.1、办理部门:医疗器械标准管理中心。
5.2.2、资料:分类界定申请表、产品照片和/或产品结构图、技术要求和编制说明、境外上市证明材料(进口产品)、其他与产品分类界定有关的材料。
5.2.3、费用:不收费。
5.2.4、时间周期:乎分类界定难度,2个月~1.5年不等。
5.3、确定注册单元
5.3.1、注册单元划分:注册单元的划分以产品的技术原理、结构组成、性能指标和适用范围为划分依据。参考《关于医疗器械注册单元划分原则公开征求意见的通知》、适用指导原则及同类已上市产品注册单元划分情况。
5.3.2、确定检验典型性型号:同一注册单元内所检验的产品应当能够代表本注册单元内其他产品的安全性和有效性,典型性型号不唯一。
原则:结构最复杂、工艺最复杂、风险最大、材质差异、性能差异
5.4、注册检验流程
5.4.1、筛选检测机构
5.4.2、申请指定检验机构(如需)
5.4.3、准备送检样品资料、送检跟检
5.4.4、不合格项修复(如需)
5.4.5、领取检验报告
5.5、申请指定检验机构
5.4.1、资料
5.4.1.1、医疗器械注册指定检验申请
5.4.1.2、待检产品的技术要求
5.4.1.3、拟指定检验机构能力证明
5.4.2、办理部门
5.4.1.1、国家局负责三类器械和进口器械注册指定检验工作
5.4.1.2、省局负责国产二类器械注册指定检验工作
5.4.3、费用:不收费。
5.4.4、时间周期:约20工作日。
5.6、注册检验
5.6.1、资料
5.6.1.1、试验合同
5.6.1.2、技术要求及编制说明
5.6.1.3、说明书
5.6.1.4、样品
5.6.1.5、其他详见检测机构官网
5.6.2、参考时间
5.6.2.1、源器械:90工作日
5.6.2.2、无源器械:45工作日
5.6.2.3、生物性能:视检验项目而定
5.6.3、费用:
5.6.3.1、查询检测机构官网.
5.6.3.2、咨询业务受理老师。
5.6.3.3、咨询代理机构。
5.7、临床评价
5.7.1、参考时间豁免目录产品
5.7.1.1、与目录内容对比
5.7.1.2、已上市同类产品对比
5.7.1.3、参考《医疗器械临床评价指导原则》编写资料
5.7.2、参考时间豁免目录产品目录外,有已上市同品种器械
5.7.2.1、判断进行临床试验还是临床文献数据、经验数据评价
5.7.2.2、编写评价资料或进行临床试验
5.7.3、未有已上市同类品种器械
5.7.3.1、参考《医疗器械临床试验质量管理规范》或《体外诊断试剂临床试验技术指导原则》进行临床试验
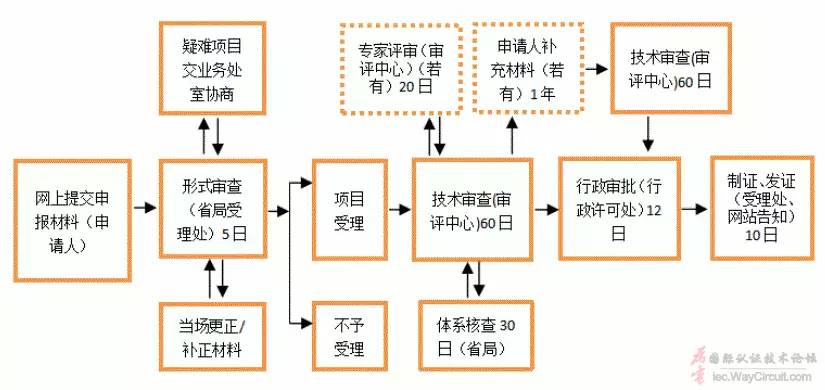
6.1、注册申报资料
6.1.1、申请表
6.1.2、证明文件
6.1.3、医疗器械安全有效基本要求清单
6.1.4、综述资料
6.1.5、研究资料
6.1.6、生产制造信息
6.1.7、临床评价资料
6.1.8、产品风险分析资料
6.1.9、产品技术要求
6.1.10、产品注册检验报告
6.1.11、说明书和标签样稿
6.1.12、符合性声明
注:参考各地办事指南及《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》
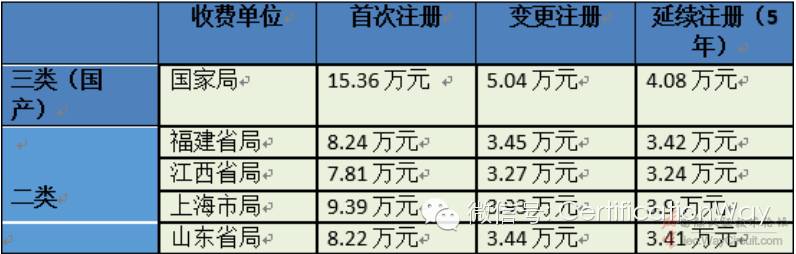
6.2、国产器械注册收费
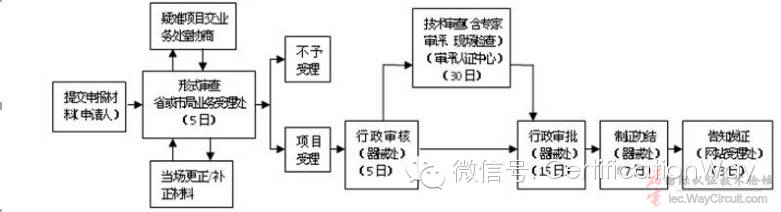
6.3、医疗器械质量管理体系核查
6.3.1、办理部门:注册受理后10个工作日向省局提交。
6.3.2、医疗器械质量管理体系核查流程
6.4、申请资料
6.4.1、医疗器械生产企业(注册申请人)基本情况表
6.4.2、医疗器械质量管理体系核查确认书
6.4.3、营业执照副本复印件
6.4.4、企业组织机构图
6.4.5、企业负责人、生产、技术和质量管理部门负责人简历,学历和职称证书复印件
6.4.6、部分注册申报资料的复印件
6.4.7、洁净厂房检验报告(如需)
6.4.8、生产场地证明文件
6.4.9、产品生产工艺流程图
6.4.10、主要生产设备和检验设备目录
6.4.11、拟核查产品与既往已通过核查产品在生产条件、生产工艺等方面的对比说明(如适用)
6.4.12、企业质量管理体系自查报告
注:参考各地办事指南及境内第三类医疗器械注册质量管理体系核查工作程序(暂行)
创新型医疗器械特别审批申请
(以国产三类为例)7.1、优惠:广告效应、专人指导、优先体考、检测、小微企业免收注册费。7.2、时限:75工作日(三类)31工作日(二类)。
7.3、办理部门:省局初审、国家局审批。
7.4、通过率:截至2016-3-18共有300多件申请,批准了55个产品,通过率约为16.7%。
7.5、申报资料:
7.5.1、创新医疗器械特别审批申请表
7.5.2、申请人企业法人资格证明文件
7.5.3、产品知识产权情况及证明文件
7.5.4、产品研发过程及结果的综述
7.5.5、产品技术文件
7.5.6、产品创新的证明性文件
7.5.7、产品安全风险管理报告
7.5.8、产品说明书(样稿)
7.5.9、其他证明产品符合食药监械管[2014]13号第二条的资料
7.5.10、所提交资料真实性的自我保证声明
注:参考《创新医疗器械特别审批程序(试行)》
7.6、创新医疗器械特别审批常见不同意理由
7.6.1、缺乏显著临床价值的支持性资料
7.6.2、不属于国内首创
7.6.3、不属于国际技术领先7.6.4、专利问题
7.6.5、查新报告不合格
7.6.5、产品未定型
8.1、格式
8.1.1、参考各地办事指南的文件样式。
8.1.2、文件内容、数量、签字、签章要求与办事指南要求一致。
8.1.3、核对后扫描存档,资料中出现公司名称、地址、产品名称、型号、预期用途均应一字不差。
8.2、网上申报: 按办事指南网上申报/无纸化申报
8.3、装订
8.3.1、参考各地的打印、装订要求。
8.3.1、封面、目录、申报资料的顺序装订成册,每项文件第一页作标签,或用带标签的隔页纸分隔。
8.4、沟通
8.3.1、法规研读:遇到困惑多向检测机构、审评中心咨询(注意咨询时间)。
8.3.2、多问:注药监部门动态、对征求意见文件认真研读,积极反馈。
8.3.3、换位思考:理解药监部门、检验机构的工作,积极配合,定期跟进。
《医疗器械监督管理条例》(国务院令第650号)官方网站链接:
http://www.sda.gov.cn/WS01/CL0784/97814.html
《医疗器械分类规则》(国家食品药品监督管理总局令第15号)官方网站链接:http://www.sda.gov.cn/WS01/CL0053/124222.html
CFDA数据库查询:
http://app1.sfda.gov.cn/datasearch/face3/dir.html